いつか書かなきゃ書かなきゃと思っていた悪性腫瘍シリーズ。
“子宮体癌”からスタートです。診断から治療まで、基本的なことをさらえるような記事にしたいと思っています。ぜひご覧下さい。
目次
1. 子宮体癌には2つのタイプがある

子宮内膜に発生した上皮性悪性腫瘍のことを子宮体癌(子宮内膜癌)といいます。好発年齢は閉経前後の40歳代後半〜60歳代です。
子宮体がんの患者数はここ20年で3倍に増えており、新規患者数も死亡数も3倍増。肥満や生活習慣、妊娠・分娩歴がない人の増加などが時代背景にあると考えられています。
子宮体癌は大きく2つのタイプに分けられます。
- Ⅰ型:エストロゲン依存性。前癌病変を経て発生するもの。比較的予後良好。
- Ⅱ型:前癌病変なく、高齢者の萎縮内膜に発生するもの。予後不良。
Ⅰ型の子宮体癌は女性ホルモンの1つであるエストロゲン刺激を受け、子宮内膜異型増殖症という前癌病変を経て、類内膜腺癌として発症します。高分化型が多く、予後は比較的良好です。子宮体癌の80〜90%程度を占めます。
Ⅱ型の子宮体癌はエストロゲンとの関連はなく、前癌病変を介さずに癌が発生します。組織型としては低分化型が多く、予後は不良です。主な組織型は、低分化型類内膜腺癌・漿液性癌・明細胞癌など。子宮体癌の10〜20%程度を占めます。
子宮体癌(子宮内膜癌)の中には、
・類内膜癌
・粘液性癌
・漿液性子宮内膜上皮内癌
・漿液性癌
・明細胞癌
・神経内分泌腫瘍
・混合癌
・未分化癌、脱分化癌
と多数の種類があり、種類によっても悪性度や治療法が変わってきます。
2. 子宮体癌のリスクとよくある臨床症状

1. リスクの鍵は”エストロゲン曝露”
子宮体癌のリスク因子は、次の通りです。
- 妊娠・分娩歴がない
- 月経不順や不妊がある
- PCOS(多嚢胞性卵巣症候群)
- エストロゲン曝露(産生腫瘍の存在、薬剤)
- 肥満
- 糖尿病
- 一部の抗エストロゲン製剤(タモキシフェン=乳癌の治療薬)
- 遺伝的素因(Lynch syndromeなど)
主にはエストロゲンに長期間さらされることが原因となります。
例えば肥満の場合、脂肪細胞のアロマターゼによりエストロゲンが合成されるため、エストロゲン産生が盛んになります。
妊娠状態ではエストロゲン作用が相対的に下がるので、妊娠・出産を経験していない人は長期的にみてエストロゲンに晒される期間が長くなります。
排卵がうまくいかず、エストロゲンに拮抗するプロゲステロンの分泌がうまくいかないPCOS(多嚢胞性卵巣症候群)なども、相対的にエストロゲン刺激が多くなるため、子宮体癌のリスクと言えます。

エストロゲン製剤の長期投与や、エストロゲンを産生する顆粒膜細胞腫などの腫瘍については、言わずもがなですね。
2. 90%の症例で不正性器出血を認める
子宮体癌の臨床症状として最も多いのが不正性器出血です。特に閉経後の不正性器出血は怪しいと思った方が良いです。
下腹部痛などが生じる場合もありますが、初期には疼痛は伴わないことがしばしば。
数ヶ月〜数年の間、不正性器出血を放置していたという人もよくいらっしゃいますが、もっと早く受診してくれていれば…!と思うことが多々あります。
性器出血は自分しか気付けないことも多いので、身体からのサインをしっかりキャッチしましょう。
3. 子宮体癌疑いの人が受診したら
超音波検査、細胞診・組織診、CT、MRIなどを行って診断します。
1. まずは超音波で子宮内膜の厚みをみる
不正出血の人が受診した場合、まず必ず行うのが内診台での経腟超音波検査です。子宮内膜の厚みを測定して、正常なのか異常なのかを判断します。
子宮内膜の厚みは月経周期によっても異なるので、一概にどこを基準とするかは難しいのですが、少なくともすでに閉経した人に関しては、無症状の場合は2〜3mmとされています。そのため、閉経後にも関わらず5〜7mm以上の子宮内膜厚がある場合は精査対象となるのです。
2. 細胞診・組織診で確定診断・悪性度診断
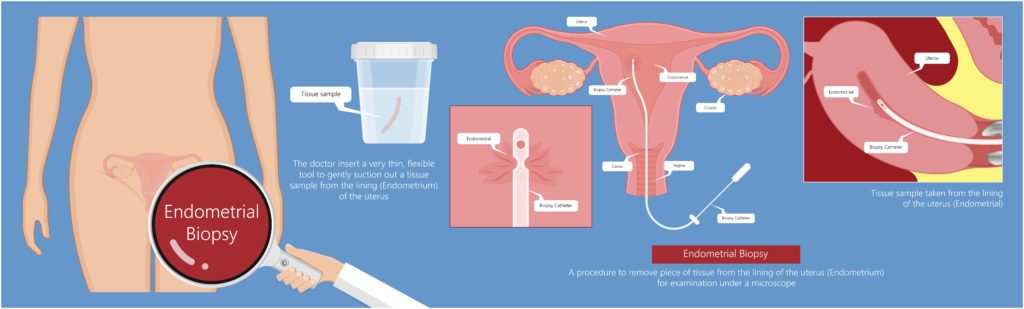
子宮内膜肥厚が悪性腫瘍によるものなのか、それ以外なのかを診断するには子宮内膜細胞診・組織診を行う必要があります。
下の記事にも書きましたが、ある程度侵襲のある検査なので、疑わしい症例にしか行いません。

組織診は確定診断のみならず、悪性度を診断することもできるため、治療方針を決定するためにも非常に役立ちます。
場合によっては子宮鏡下生検あるいは麻酔下の全面搔爬術として行います。
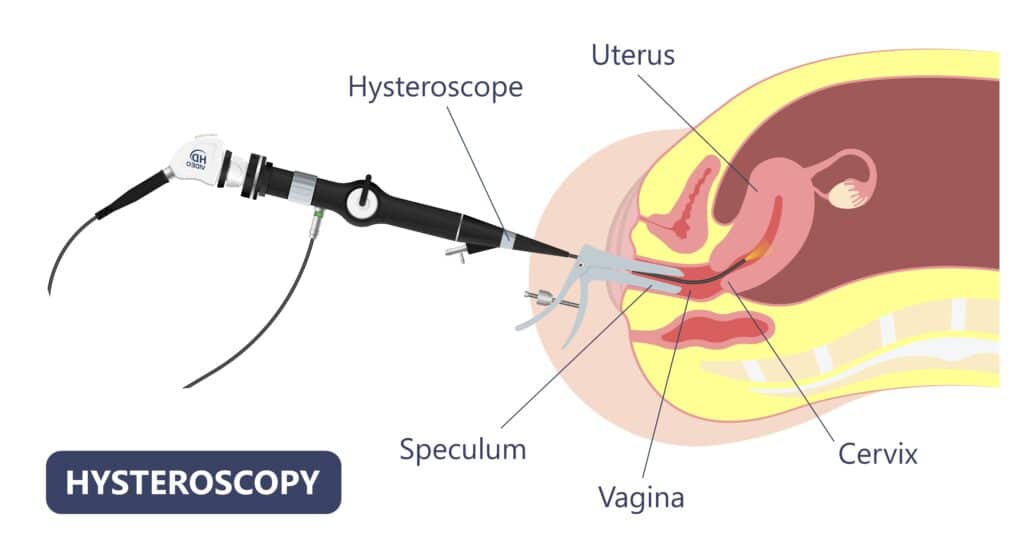
3. 画像検査・腫瘍マーカーで評価
確定診断が得られた後、進行期決定のためにCTとMRIの撮像を行います。
癌が進展するとCA125, CA19-9が上昇することがあるので、腫瘍マーカーのチェックも重要です。
4. 進行期分類(Stage)と予後について

- Ⅰ期:癌が子宮体部に限局
ⅠA期:癌が子宮筋層1/2未満
ⅠB期:癌が子宮筋層1/2以上 - Ⅱ期:癌が頸部間質に浸潤するが、子宮をこえない
- Ⅲ期:癌が子宮外に広がるが小骨盤腔をこえない、または所属リンパ節へ広がる
ⅢA期:子宮漿膜or付属器を侵す
ⅢB期:腟or子宮傍組織へ広がる
ⅢC期:骨盤リンパ節or傍大動脈リンパ節転移陽性 - Ⅳ期:癌が小骨盤腔をこえているか、明らかに膀胱or腸粘膜を侵す、遠隔転移がある
ⅣA期:膀胱or腸粘膜浸潤のあるもの
ⅣB期:腹腔内or鼠径リンパ節を含む遠隔転移がある
手術進行期分類を上に示しました。
日本における進行期の分布は、Ⅰ期が73%、Ⅱ期が6%、Ⅲ期が14%、Ⅳ期が7%。比較的早期のStageで見つかることが多くなっています。
2010年治療開始例の進行期別5年生存率は
- Ⅰ期:94.3%
- Ⅱ期:88.8%
- Ⅲ期:74.0%
- Ⅳ期:26.6%
です。また、予後は組織型や異型度(Grade)によっても異なり、次のようになっています。
- 類内膜癌G1:95.4%
- 類内膜癌G2:87.3%
- 類内膜癌G3:71.0%
- 明細胞癌:65.3%
- 漿液性癌:57.1%
5. 治療の基本は手術療法
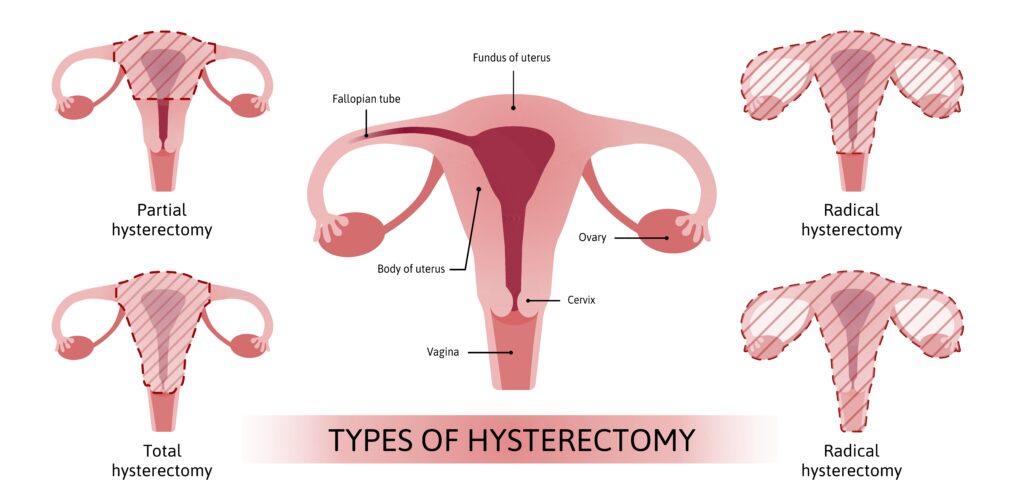
1. 手術のキホン
例外を除き、子宮体癌に対する治療の基本は、
子宮全摘術+両側付属器切除(+大網切除術±リンパ節生検・郭清)
になります。併せて腹水細胞診を採取して、細胞診の評価も行います。
両側の卵巣を切除すると、医学的に閉経することになってしまいますので、若年患者の場合は卵巣を温存する選択肢を取ることもあります。
ただしその場合は、残存した卵巣に癌が再発するリスクが懸念されるので、メリットとデメリットを天秤にかけて検討します。
またリンパ節郭清についても、進行期決定のために必要ではあるのですが、「手術に伴う合併症が増加する」などの観点から、適用については患者さん毎に慎重に判断する必要があります。
その部位のリンパ節を全部摘出する”リンパ節郭清術”ではなく、一部のリンパ節だけを摘出する”リンパ節生検”のみで終わることもあります。
2. 術後の後療法について
子宮体癌の手術を行った後、病理の検査で組織型の種類や悪性度、浸潤の程度、他臓器転移の有無を確認し、再発のリスクを評価します。
再発リスクが低いと判断されれば、特に術後の後療法は行いません。
一方、中・高リスクに対しては化学療法または放射線療法などを行います。ホルモン療法を行うこともあります。
手術が出来ない進行症例や再発症例についても、化学療法や放射線治療を選択して加療します。
3. 妊孕性温存治療(高用量MPA療法)について
子宮体癌の手術は子宮全摘術が必要。そのため、手術をしたら将来日本での妊娠はかなり難しくなります(代理母出産や子宮移植が必要で、それらは日本では承認されていないのです)。
そのため、若年で妊孕性温存を望む場合は高用量MPA療法を行う場合もあるのです。
しかしそのためには下記の条件を”全て”満たす必要があります。
子宮体がんで高用量MPA療法が考慮されるのは
- Grade1(高分化型)
- 類内膜がん
- 子宮の筋層や子宮体部外への進展がない
- 転移がない
治療は、病巣が消失するまで継続します。
副作用として血栓症があるため、アスピリンの併用も考慮します。
しかし若年体癌の半数以上が本治療の適応にならないことは知っておかないといけません。
さらにこの条件で行っても、完全に子宮体癌が治癒する率は55%、再発率は57%と、手術±後療法の治療法と比べてどうしても奏功率は下がります。
将来の妊孕性と子宮体癌の顔つきや進行度から、適切に治療を選んでいく必要があるのです。
6. 結語
- 子宮体癌は閉経前後の女性に好発する
- エストロゲン刺激に長期に晒されることがリスクになる
- 特に不正性器出血には注意が必要
- 治療は手術療法が原則
- 後療法の有無は再発リスクに応じて判断する
- 条件付きで妊孕性温存療法が行われる場合もある
- 手術不能な症例では化学療法や放射線治療が選択される
異常な性器出血がサインになります。少しでもおかしいと思ったら、産婦人科に受診してください!
今日は子宮体癌についてまとめてみました。
子宮体癌は子宮体癌でも色々な種類があり、それによって行う治療や選択肢が様々であることが分かったのではないかと思います。
子宮頸癌や卵巣癌などもまとめていこうと思いますのでお待ちください!
最後に、少しでも多くの方にこのブログをご覧いただけるよう、応援クリックよろしくお願いします!































こんにちは、ゆきです。産婦人科医として働いています。